Chagas-Krankheit
Die Chagas-Krankheit (Amerikanische Trypanosomiasis) wurde 1909 nach ihrem Entdecker, dem brasilianischen Arzt Carlos Justiniano Ribeiro Chagas (* 9. Juli 1879 in Oliveira, † 8. November 1934 in Rio de Janeiro) benannt, der am Oswaldo-Cruz-Institut arbeitete und in Rio de Janeiro lebte. Untersuchungen an Mumien der präkolumbianischen Kulturen zeigen, dass bereits die Ureinwohner Lateinamerikas dieser Erkrankung ausgesetzt waren.
Erreger:
Trypanosoma cruzi (Protozoa, Zoomastigophora, Gewebsflagellat). Die 1920 entdeckte Trypanosomenform Trypanosoma rangeli kann zwar ebenfalls den Menschen befallen und mehrere Monate im Blut nachgewiesen werden, ruft aber keine Erkrankung hervor.
Verbreitung:
Mexiko, tropisches Mittel- und Südamerika, die südliche Grenze liegt auf der Höhe der nördlichen Provinzen Argentiniens und Chiles, vereinzelt wurden Erkrankungsfälle in den Südstaaten der USA beschrieben. Zur Zeit sind ca. 16-18 Millionen Menschen mit der Chagas-Krankheit infiziert und ca. 120 Millionen akut gefährdet. Das Infektionsrisiko steht in direktem Zusammenhang mit der Armut.
Infektionsweg:

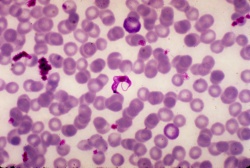
Übertragen wird die Chagas-Krankheit durch Raubwanzen (Spezies Reduviidae), insbesondere durch Triatoma infestans und Panstrongylus megistus. Die Raubwanzen leben bevorzugt in Wandritzen und Strohdächern. Während des Blutsaugens, hauptsächlich nachts, setzen die Raubwanzen infektiöse Faeces (Stuhl) ab, diese können Konjunktiven, Schleimhäute oder kleinste Hautverletzungen kontaminieren. Aufgrund des Juckreizes, verursacht durch den Stich, werden die Erreger häufig in den Stichkanal eingerieben. Die Infektion der Raubwanze erfolgt ausschließlich durch Saugen an parasitämischen Wirten, transovarielle Übertragung ist extrem selten. Neben dem Menschen fungieren mehr als 150 verschiedene Spezies, u. a. Haus- und Nutztiere, als Reservoir. Insbesondere in Brasilien stellt die Übertragung, auch in der jahrzehntelangen Latenzphase, durch Bluttransfusionen und Organtransplantationen zunehmend ein Problem dar. Auch transplazentar können die Erreger übertragen werden.
Dauer der Inkubation:
5-14 Tage nach Übertragung durch Raubwanzen, 30-40 Tage nach Bluttransfusion
Symptomatik:
Die Erkrankung durchläuft drei Stadien:
- 1. Akute Krankheitsphase: Nur ca. 30-40% der neuinfizierten Personen entwickeln akute Krankheitssymptome (die akute Chagas-Krankheit ist zumeist eine Erkrankung von Kindern). Nach Infektion entwickelt sich häufig an der Eintrittsstelle des Erregers eine lokale Schwellung und Rötung (Chagom). In ca. 5-10% der Fälle ist das Ober- und Unterlid eines Auges betroffen (Romaña-Zeichen). Ein Chagom kann bis zu 8 Wochen persistieren. Nach einigen Tagen können ca. 2 Wochen anhaltende Allgemeinsymptome wie Fieber, Übelkeit, Durchfälle, Anämie, Lymphadenopathie, Hepatosplenomegalie sowie teigige, stamm- und gesichtsbetonte Ödeme, feinfleckige großflächige Erytheme oder urtikarielle Hauterscheinungen auftreten. Insbesondere bei Neugeborenen oder Kleinkindern verschlechtern Myokarditiden und Meningoenzephalitiden die Prognose. In 5-10% der Fälle führen kardiale oder zerebrale Komplikationen in der akuten Krankheitsphase zum Tode. Bei Immunschwäche durch HIV kann die zerebrale Beteiligung bereits in der akuten Krankheitsphase sehr ausgeprägt sein.
- 2. Latenzphase: Während dieser langandauernden Phase sind die Patienten symptomfrei. Selten kann es bei Patienten, die unter Erkrankungen leiden, die mit einer Schwächung des Immunsystems einhergeht, zum Wiederauftreten von akuten Krankheitssymptomen kommen.
- 3. Chronische Krankheitsphase: Bei ca. 10-20% der infizierten Personen führt die fortschreitende, wahrscheinlich autoimmunologisch bedingte Schädigung von neuronalem oder mesenchymalem Gewebe zu chronischen Organdefekten. Die bedeutendste Spätfolge, sowohl zahlenmäßig als auch prognostisch, stellt die Manifestation am Herzen dar. Die Symptome reichen von Angina pectoris über Reizleitungs- oder -bildungsstörungen bis hin zum Pumpversagen bei typischer Kardiomyopathie. Relativ häufig tritt der plötzliche Herztod oder thrombembolische Komplikationen auf. Zumeist ist der Ursprungsort dieser Thromben ein selten rupturierendes Herzspitzenaneurysma. Intestinale Megabildungen, wie Megaösophagus, Megaduodenum oder Megacolon werden hauptsächlich in den südlichen Endemiegebieten beobachtet. Bei Patienten mit Megaösophagus kommt es häufig zu Aspirationspneumonien, auch die Inzidenz von Ösophaguskarzinomen ist erhöht (gilt jedoch nicht als Präkanzerose). Patienten mit einem Megacolon leiden an chronischer Obstipation (es kann zur wochenlanger Stuhlverhaltung kommen) und abdominellen Schmerzen. Toxisches Megacolon, Volvulus oder Darmperforation sind häufige Todesursachen. Seltener wurden zentralnervöse Symptome während der chronischen Krankheitsphase beschrieben.Bei HIV-infizierten Patienten kann die ZNS-Infektion durch Trypanosoma cruzi Symptome wie eine zerebrale Toxoplasmose hervorrufen. Auch hier zeigen sich im Computertomogramm kontrastmittelanreichernde, ringförmige Läsionen.
Therapie:
Eine Behandlung ist möglich, jedoch problembehaftet. Zur Therapie werden die Wirkstoffe Nifurtimox (Lampit®) und Benznidazol eingesetzt. Besonders in der akuten Phase sind diese Medikamente doch recht wirksam, da sie die Parasiten im Blut vernichten. Die Behandlung dauert mindestens 7 Wochen, kann aber im Bedarfsfall auch bis zu 3 Monate durchgeführt werden. In der chronischen Phase müssen gezielt die Symptome behandelt werden, es ist keine effektive Heilung zu erwarten.
Prophylaxe:
In erster Linie durch Vektorbekämpfung. Beseitigung oder Insektizidbehandlung von Strohdächern, Ritzen in Wänden und Böden. Serologisches Screening von Blutspendern in endemischen Gebieten, der Zusatz von Gentianaviolett zu Blutkonserven vermindert das Übertragungsrisiko.
Diagnostik:
Der Parasitennachweis gelingt hauptsächlich in der akuten Krankheitsphase und ist aufgrund der sehr niedrigen Parasitendichte in der chronischen Krankheitsphase seltener erfolgreich.- direkter Nachweis aus dem Blut (Lymphknoten oder Skelettmuskel seltener) oder mit Hilfe von Konzentrationsmethoden (dicker Tropfen, aus dem buffy coat) nativ oder Giemsafärbung
- Blutkultur
- Xenodiagnostik mit Hilfe von infektionsfreien Raubwanzen, Nachweis der Erreger mehrere Wochen später im Raubwanzenkot
Immundiagnostik:
ELISA, IFT. Vor allem in der Latenz- und chronischen Phase von Bedeutung. Sechs Monate nach Infektion nahezu 100% Serokonversion (Kreuzreaktionen mit Leishmaniosen sind möglich).
Gesetzliche Regelungen:
Meldepflicht: Das Infektionsschutzgesetz sieht bei Trypanosomiasis keine explizite namentliche Meldepflicht vor. Allerdings sollte die Erkrankung nach IfSG §6, Abs. 1, Zi. 5 als "bedrohliche Erkrankung" gemeldet werden. Patienten, die an Chagas erkrankt sind oder waren, sind von einer Blutspende ausgeschlossen.
Tipps für Reisende:
Bis jetzt gibt es keine Impfung um Chagas vorzubeugen. Jedoch laufen große Bekämpfungsprogramme, die nun langsam zu greifen beginnen. Was sollte der Reisende beachten, wenn er in betroffene Gebiete fährt:
- Nach Möglichkeit nicht in Lehmhütten und Häusern mit Palmdächern zu übernachten.
- Der beste Schutz ist die Verwendung von Moskitonetzen, wenn man unter Palmdächern oder in Lehmhütten übernachtet.
- Die Verwendung von Insektizide ist ratsam, um das Übertragungsrisiko zu vermindern.
Literatur
- Robert Koch-Institut
