ECMO
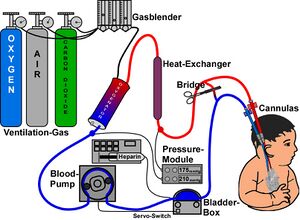
Die Extrakorporale Membranoxygenierung (ECMO) ist eine intensivmedizinische Technik, mit der eine Maschine teilweise oder vollständig die Atemfunktion von Patienten übernimmt. Sie wird angewendet zur Sicherstellung der Atemfunktion bei Patienten, deren Lungen schwerst geschädigt sind (ARDS) und den Gasaustausch nicht mehr im ausreichenden Maß ermöglichen.[1] Sie wird oft bei Neugeborenen eingesetzt, die an Lungenschäden (Atemnotsyndrom, Mekoniumaspiration, persistierende pulmonale Hypertonie) leiden.
Die ECMO ist damit eine Form der extrakorporalen Organersatzverfahren und wird auch als Extracorporeal Life Support (extrakorporale Lebensunterstützung, ECLS) genannt.
Die ECMO kann über Tage oder Wochen eine ausreichende Oxygenierung gewährleisten und gibt damit der Lunge Zeit, ohne aggressive Beatmung zu heilen. Trotzdem wird die ECMO wegen der hohen technischen Anforderungen, Kosten und Komplikationsrisiken (z.B. Blutungen) als eine letzte Therapiemöglichkeit (Ultima ratio) betrachtet.
Technik
Technisch gleicht ein ECMO-Gerät einer Herz-Lungen-Maschine. Um eine ECMO aufzunehmen, werden Kanülen in zwei große Blutgefäße eingebracht. Eine Blutgerinnung wird durch das Hinzufügen gerinnungshemmender Mittel wie Heparin (Antikoagulanzien) vermieden. Das ECMO-Gerät pumpt Blut kontinuierlich durch einen Membran-Oxygenator, der den Gasaustausch in der Lunge ersetzt: Er entfernt Kohlendioxid aus dem Blut und reichert es mit Sauerstoff an. Das so aufbereitete Blut wird dann zum Patienten zurückgeführt.

Varianten der ECMO
Es existieren verschiedene Formen der ECMO, die wichtigsten sind die Veno-Venöse ECMO (VV-ECMO) und die Veno-Arterielle ECMO (VA-ECMO). Entnommen wird das Blut bei beiden Versionen aus großen Venen. Bei der VV-ECMO wird das oxygenierte Blut dann wieder in eine Vene eingeleitet, es ist bei schweren Lungenversagen mit noch ausreichender Funktion des Herzens indiziert. Bei der VA-ECMO hingegen wird das Blut am Herzen vorbei in eine Arterie geleitet, so dass ein Parallelkreislauf entsteht. Da dadurch das Herz entlastet ist, wird diese Methode bei Patienten mit schlechter Pumpfunktion des Herzens (Herzinsuffizienz) eingesetzt.
ECMO beim Erwachsenen

Die erste Anwendung eines kardiopulmonalen Bypasses zur Therapie eines Lungenversagens (ARDS) fand Anfang der 1970er Jahre statt.[2] Mit der Aussicht auf ein wirkungsvolles Therapieinstrument zur Behandlung des ARDS startete die National Institutes of Health (Oberste Gesundheitsbehörde der USA) eine ARDS-Multicenterstudie. Die Ergebnisse waren ernüchternd: Die Gruppe mit ECMO-Behandlung zeigte kein besseres Behandlungsergebnis, die Studie wurde vorzeitig abgebrochen.[3] Die Studie war trotz methodischer Mängel ein Rückschlag für die ECMO-Entwicklung. Die Forschung konzentrierte sich infolgedessen wieder verstärkt auf die Verbesserung der herkömmlichen Beatmungsverfahren.
Erst in den 1980er Jahren konnte eine italienischen Forschergruppe mit verbesserten Methoden einen Nutzen der ECMO aufzeigen, allerdings in einer nicht-kontrollierten Studie.[4] Bis heute gilt das Ergebnis dieser und anderer Folgeuntersuchungen, dass die ECMO beim ARDS des Erwachsenen von Nutzen sein kann, allerdings ohne bisher einen signifikanten Vorteil gegenüber einer Beatmungstherapie belegen zu können.[5] 2006 wurde in Großbritannien eine randomisierte Multicenterstudie mit 80 Zentren und 180 Patienten beendet, um den Stellenwert einer ECMO zur ARDS-Therapie festzustellen.[6] Vorab veröffentlichte Ergebnisse[7] scheinen für den Einsatz der Extrakorporalen Membranoxygenierung beim Lungenversagen des Erwachsenen günstig zu sein[8].
Die ersten erfolgreichen Anwendungen von extrakorporalem Gasaustausch (ECMO, ELA, ECLA, ECCO2-R) in Deutschland wurden bei akutem Lungenversagen des Erwachsenen in den Jahren 1971 und 1983 an der Universität Düsseldorf [9][10], sowie bei Verbrennungen erstmals 1975 von Rommelsheim und Birtel an der Klinik für Anästhesiologie der Universität Bonn durchgeführt [11][12].
ECMO beim Neugeborenen

Bartlett berichtete 1975 über die erste erfolgreiche neonatale ECMO-Anwendung in Kalifornien. Dem folgte die erste richtungsweisende Studie, die ein erhöhtes Überleben durch die Behandlung zeigte.[13][14] Das im Vergleich zum Erwachsenen deutlich bessere Ansprechen einer ECMO-Therapie beim Neugeborenen führte zu einer zunehmenden Zahl an ECMO-Behandlungsfällen und ECMO-Zentren, zunächst in den USA und später auch weltweit.
Im Februar 1987 wurde in der Mannheimer Kinderklinik die erste erfolgreiche ECMO-Anwendung bei einem Neugeborenen im deutschsprachigen Raum durchgeführt.[15]1994 bis 1995 wurde in Großbritannien eine randomisierte Multicenterstudie bei Neugeborenen durchgeführt. Aufgrund der signifikant höheren Überlebensrate in der ECMO-Behandlungsgruppe wurde die Studie im November 1995 frühzeitig abgebrochen, da die Fortführung ethisch nicht vertretbar war.[16] Die Studie widerlegte auch in nachfolgenden Folgeuntersuchungen die Befürchtung, dass die höhere Überlebensrate in der ECMO-Behandlungsgruppe durch psychomotorischen Defizite „erkauft“ würde. Stattdessen bleibt der Nutzen der ECMO auch in der Nachuntersuchung der Kinder erhalten.[17]
Extracorporeal Life Support Organization (ELSO)
1989 wurde ein zentrales ECMO-Register in Ann-Arbor, Michigan (USA) eingerichtet. Dort werden ECLS-Anwendungen zentral registriert und detailliert aufgeschlüsselt. Das erlaubt eine genaue Übersicht über die Effektivität und den Fallzahlverlauf der Therapie bei bestimmten Krankheitsbildern. Dadurch können therapiespezifische Verbesserungen oder Probleme im Bereich ECLS-Anwendungen rascher erkannt und an andere ECMO-Zentren weitergegeben werden. Bis Ende 2006 wurden weltweit mehr als 31.000 ECLS-Anwendungen der Extracorporeal Life Support Organization (ELSO) berichtet und statistisch ausgewertet. Derzeit sind der ELSO 115 aktive ECMO-Zentren weltweit gemeldet.
Beatmung während ECMO-Therapie
Während bei herkömmlicher Beatmung das Hauptaugenmerk auf der Oxygenierung und der Elimination des CO2 liegt, sind dies bei einem ECMO-pflichtigen Patienten verständlicherweise keine Kriterien, die Einfluss auf das Setting des Respirators haben. Hier wird vielmehr eine besonders schonende Beatmung gewählt, um eine schnelle Rekonvaleszenz der Lunge zu forcieren. Dies bedeutet sowohl ein lungengewebsschonendes FiO2, (circa 0,21 -0,3), als auch möglichst niedrige Beatmungsdrücke, die eine Beatmung von circa 3-6 ml pro kg/KG zulassen. In der Regel wird eine druckkontrollierte Beatmung mit einem niedrigen PEEP von 3-5 mbar gewählt.
Pflegerische Aspekte
Ein Patient, der aufgrund eines Lungenversagens oder zur Entlastung des Herzens einen extrakorporalen Kreislauf benötigt, ist immer ein kritischer Patient. Sein (Über-)Leben ist abhängig vom Funktionieren der ECMO. Daher ist diese regelmäßig zu kontrollieren:
- Flussrate
- Umdrehungen
- Akkulaufzeit
- Blutkoagel im Oxygenator
- Sicherung der Schläuche vom und zum Patienten
- Blutungen an den Einstichstellen
- Blutgasanalysen circa 2-stündlich bzw. 10 min nach Veränderungen am Gerät
Der Patient sollte nach Möglichkeit (und Art der Kanülierung) wenig bewegt oder gedreht werden, da die sehr starren Schläuche keinesfalls disloziert werden dürfen. Häufig sind ECMO-pflichtige Patienten ohnehin sehr kreislaufinstabil und tolerieren daher jegliche Mobilisation nur sehr schlecht. Daraus folgert eine adäquate Dekubitusprohylaxe mittels Gel- oder Wechseldruckmatratze (RIK™ Fluid Overlay [18] oder TheraKair[19]). Ist ein Drehen des Patienten unumgänglich, so sollte dies mit möglichst viel Personal geschehen (3-5 Personen), dabei befinden sich 2-3 Personen auf der Seite des Patienten, in die er gedreht werden soll; eine weitere Person steht am Kopfende und sichert ZVK, Tubus und bei Kanülierung via Vena jugularis/subclavia die Kanülen. Falls der Zugangsweg via Femoralvene gewählt wurde, ist die Person, die sich dort befindet, mit der Sicherung der Kanülierung betraut. Grundsätzlich sollte in Richtung Beatmung/ECMO gedreht werden, um Zugkräfte auf die Schläuche und Kanülen zu vermeiden. Eventuell ist das Einbringen eines Stuhldrainage-System zu erwägen (z.B. Flexi-Seal ©[20] [21])
Ist der Patient - wie in der Herzchirurgie üblich - herznah kanüliert und die Austrittspforte befindet sich unterhalb des Xiphoids, sollten die Schläuche unterpolstert werden, um Druckstellen auf der Bauchdecke zu vermeiden; hierzu eignen sich klinikübliche Handtücher.
Literatur
- ↑ Kopp R et al: Extrakorporale Membranoxygenierung beim akuten Lungenversagen. Der Anaesthesist, 2004; 53:168-174
- ↑ Hill JD, O'Brien TG, Murray JJ, et al: Prolonged extracorporeal oxygenation for acute post-traumatic respiratory failure (shocklung syndrome). N Eng J Med 1972; 286:629 PMID 5060491
- ↑ Zapol WM, Snider MT, Hill JD, et al: Extracorporeal membrane oxygenation in severe acute respiratory failure. A randomized prospective study. JAMA 242: 2193-2196, 1979. PMID 490805
- ↑ Gattinoni L, Pesenti A, Mascheroni D et al: Low- frequency positive- pressure ventilation with extracorporeal CO2 removal in severe acute respiratory failure. JAMA 1986;256: 881-886,. PMID 3090285
- ↑ Mols G et al: Zehn Jahre Erfahrung mit extra-korporaler Membranoxygenierung (ECMO). Anästhesiol Intensivmed Notfallmed Schmerzther 2001; 36: 4-14
- ↑ Peek GJ, Clemens F, Elbourne D, Firmin R, Hardy P, Hibbert C, Killer H, Mugford M, Thalanany M, Tiruvoipati R, Truesdale A, Wilson A. CESAR: Conventional ventilatory support vs extracorporeal membrane oxygenation for severe adult respiratory failure.BMC Health Services Research. 2006;6:163
- ↑ Peek G. CESAR: adult ECMO vs conventional ventilation trial. Society of Critical Care Medicine 37th Critical Care Congress; February 2-6, 2008; Honolulu. Zusammenfassung in: Schuerer 2008.
- ↑ Schuerer DJ, Kolovos NS, Boyd KV, Coopersmith CM. Extracorporeal membrane oxygenation: current clinical practice, coding, and reimbursement. Chest 2008 Jul;134(1):179-84
- ↑ Schulte HD, Bircks W, Dudziak R.: Preliminary results with the Bramson membrane lung. (Also report of a successful, clinical long-term perfusion) Thoraxchir Vask Chir. 1972;20:54-9. PMID 4537173
- ↑ Thies WR, Breulmann M, Lenhsen U, Pet al.: Pulmonary function during a 10-day successful extracorporeal CO2 elimination in acute respiratory failure. Case report Der Anaesthesist. 1985 Apr;34:197-202. PMID 3923858
- ↑ Rommelsheim K, Birtel FJ, Seidat KH et al.: Anwendung der "GE-DUALUNG" bei pulmonaler Diffusionsstörung nach einem Verbrennungsfall. Wissenschaftl. Inform. d. Freseniusstiftg. 1975; 4:185
- ↑ Rommelsheim K, Birtel FJ, Seidat KH, et al.: Prolongierte extrakorporale Membranoxygenisierung wegen Schocklunge bei drittgradiger Verbrennung. Prakt. Anästhesie 1976; 11:8-16 PMID 967804
- ↑ Bartlett RH, Gazzaniga AB, Jefferies MR et al: Extracorporeal membrane oxygenation (ECMO) cardiopulmonary support in infancy. Trans Am Soc Artif Intern Organs 1976;22:80-93. PMID 951895
- ↑ Bartlett RH, Gazzaniga AB, Toomasian J et al. Extracorporeal membrane oxygenation (ECMO) in neonatal respiratory failure. 100 cases. Ann Surg. 1986; 204: 236-45 PMID 3530151
- ↑ Kachel W, Arnold D: Schriftenreihe Intensivmedizin Notfallmedizin Anästhesiologie Band 73 Extrakorporale Membranoxygenierung beim Neugeborenen 1. deutschsprachiges Symposium in Mannheim
- ↑ UK collaborative randomised trial of neonatal extracorporeal membrane oxygenation. Lancet 1996; 348: 75-82
- ↑ McNally H, Bennett CC, Elbourne D et al.:United Kingdom Collaborative Randomized Trial of Neonatal Extracorporeal Membrane Oxygenation: Follow-up to Age 7 Years. Pediatrics 2006;117:e845-e854
- ↑ http://www.kci1.com/cs/Satellite?c=KCI_Product_C&childpagename=CH-GER%2FKCILayout&cid=1229626131154&p=1229626133401&packedargs=locale%3Dde_CH&pagename=CH-GERWrapper
- ↑ http://www.kci1.com/cs/Satellite?c=KCI_Product_C&childpagename=CH-GER%2FKCILayout&cid=1229626131200&p=1229626133401&packedargs=locale%3Dde_CH&pagename=CH-GERWrapper
- ↑ Intensiv Fachzeitschrift für Intensivpflege und Anästhesie 5/09 S.267
- ↑ http://www.convatec.de/de/cvtde-oursltnfde/cvt-portallev1/0/detail/0/984/2294/unsere-loesung-flexi-seal-fms.html
Weblinks
- ECMO im Kinderzentrum Mannheim
- ECMO-Zentrum der Kinderkliniken im Klinikum Bremen
- Extracorporeal Life Support Organization
- Mini-ECMO am Bergmannsheil Bochum: Mini-Herzlungenmaschine für Krankentransporte
- (CESAR-Studie) Conventional Ventilation of ECMO for Servere Adult Respiratory Failure
- ECMO-Informationen für Eltern (PDF) (1022 kB)
| Hinweis: Dieser Artikel basiert auf einem Text, der aus der freien Enzyklopädie Wikipedia übernommen wurde. Eine Liste der ursprünglichen Autoren befindet sich auf der Versionsseite des entsprechenden Artikels. |